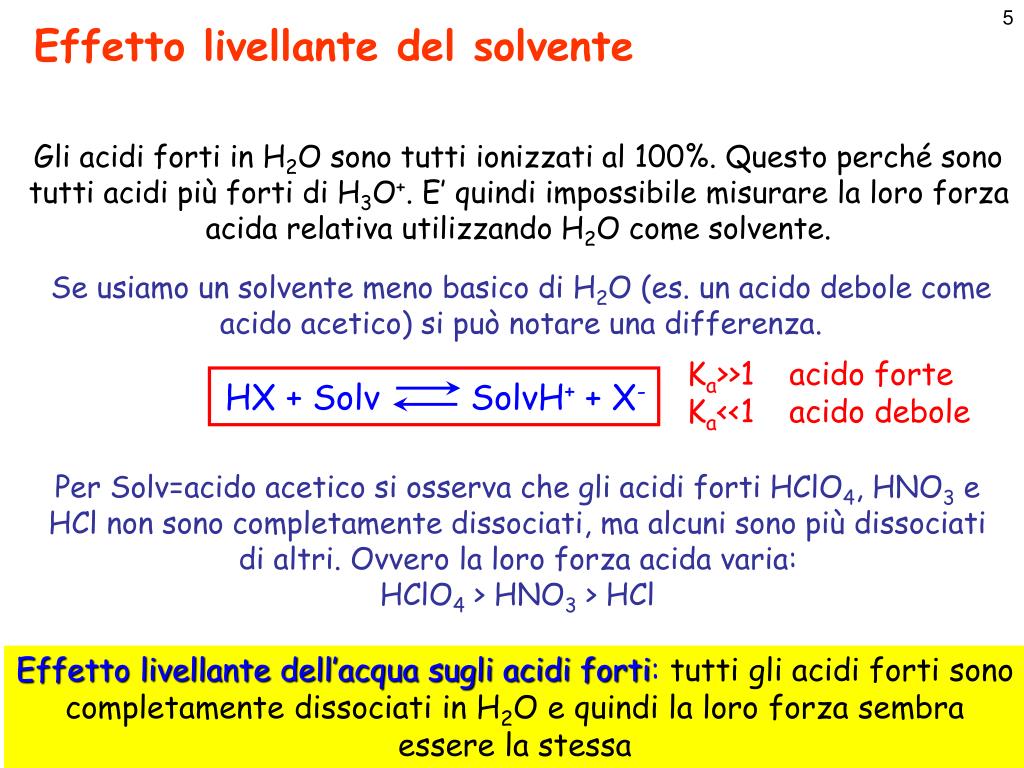
Tabella con i valori della K a e della K b dei principali acidi e basi. Per un generico acido HA che si dissocia in acqua secondo il seguente equilibrio: l'espressione della costante acida (k a) è la seguente: Tanto più questo valore è piccolo tanto meno forte è l'acido considerato. Il valore della costante acida è pertanto una misura di.. Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+. 2.

Titolazioni acido base Cos'è una titolazione, titolazione base forte con acido forte, base
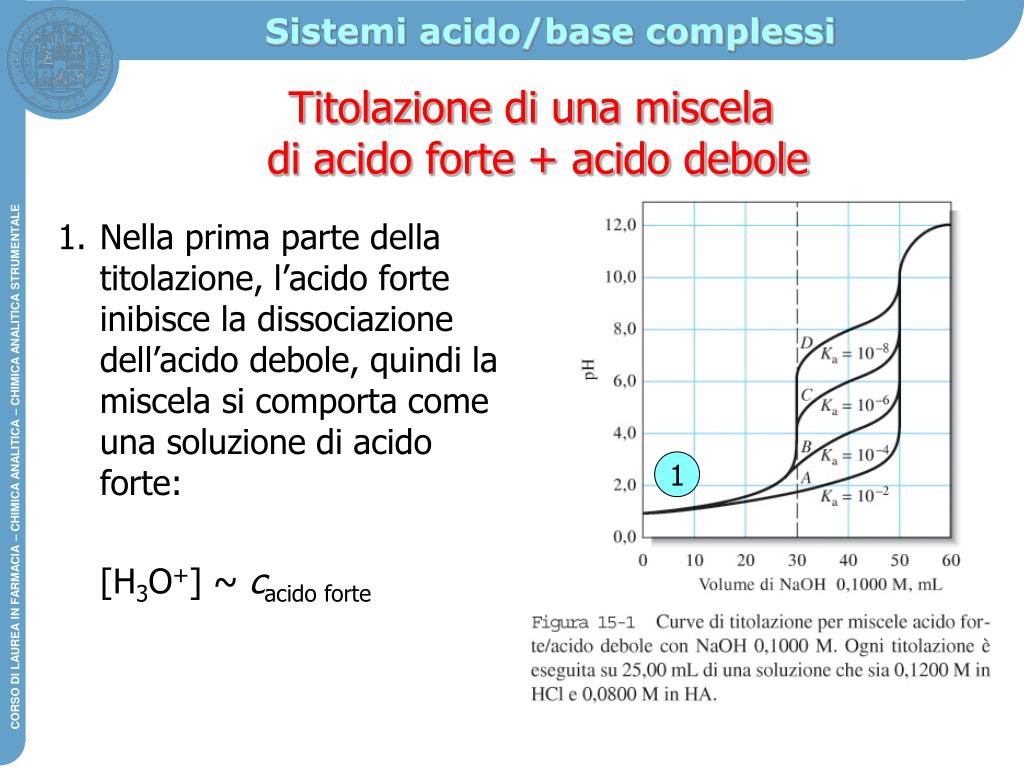
Grafico Titolazione Acido Debole Base Forte oqudina

Titolazioni acido debole base forte. Esercizi svolti Chimicamo

Hcl Acido Forte O Debole princeselsa
Curva di titolazione acido debole base forte Nel
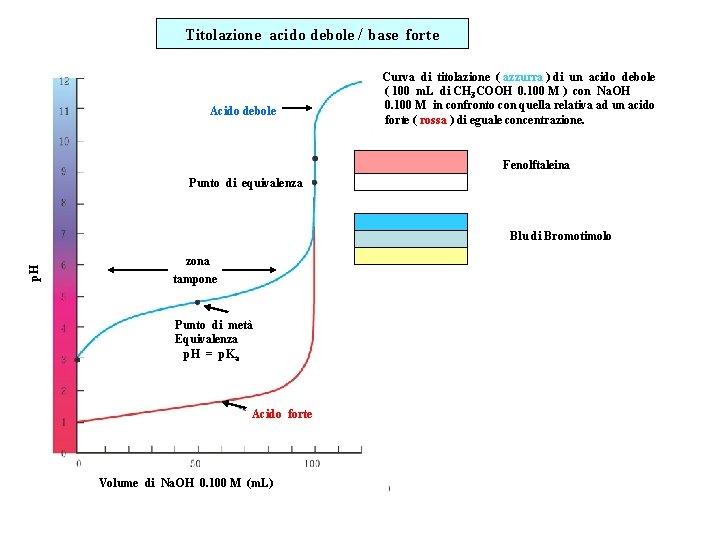
25 m L Na OH 0 250 M

Nh3 Base Forte O Debole kasrusso
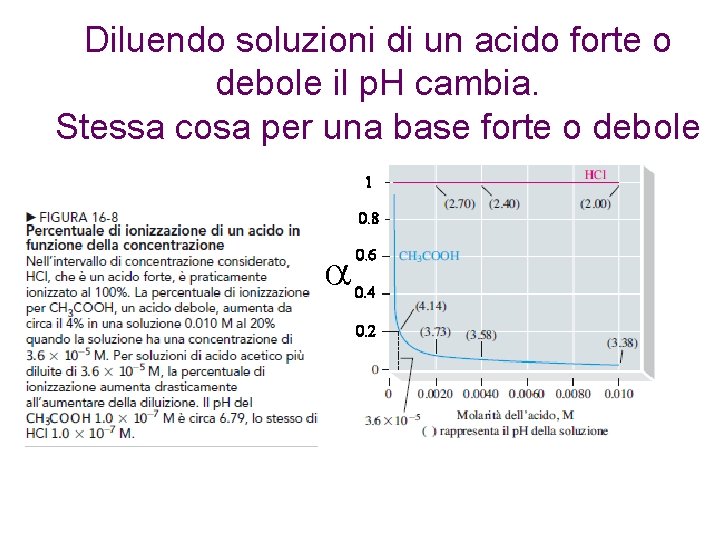
Diluendo soluzioni di un acido forte o debole
Hno3 Acido Forte O Debole thaqabia
Ph Acido Debole Base Forte sulikrah

Curva di titolazione acido debole base forte Nel

Neutralizzazione di un acido debole con una base forte YouTube

Hcl Acido Forte O Debole princeselsa

Tabella Acidi Forti E Deboli sanuwest

Ph Acido Debole Base Forte sulikrah
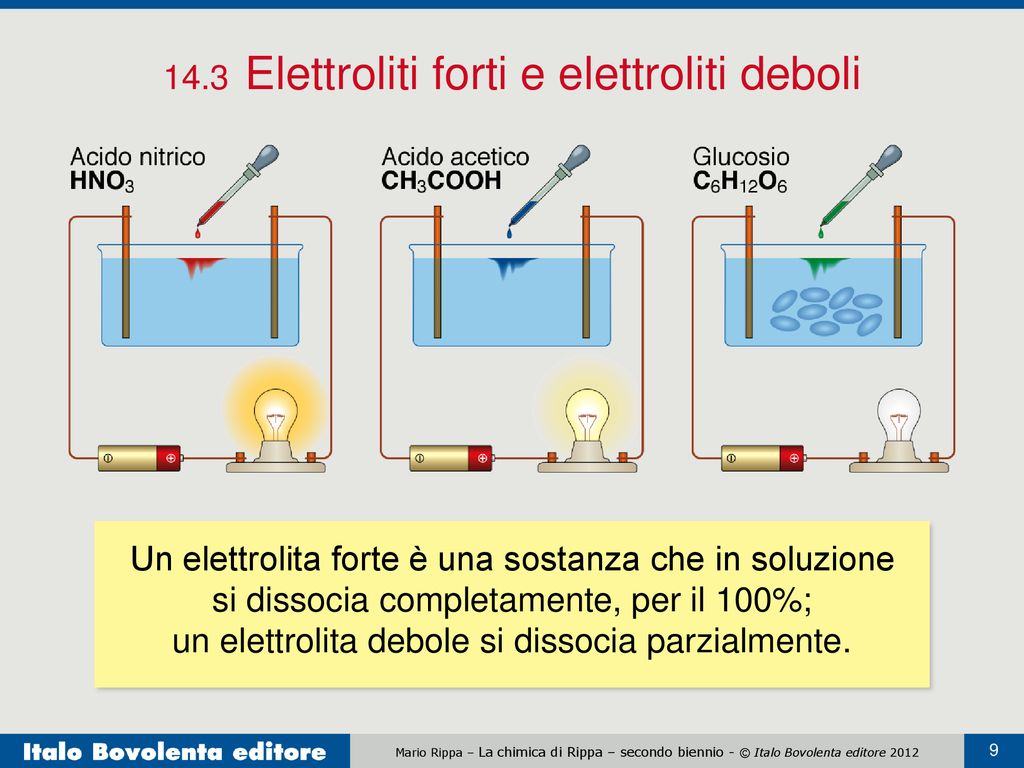
Quando un elettrolita si dice forte? Qual è lo

Come si fa a capire se un acido e debole o forte? (2023)

Titolazione Acido Debole Base Forte Punto Equivalente marjetti

Diluendo soluzioni di un acido forte o debole

ACIDI E BASI FORTI E DEBOLI YouTube
Capire la forza di un acido. Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+.. L'acqua è una base debole mentre il suo acido coniugato H 3 O+ è forte. Si consideri la dissociazione dell'ammoniaca: NH 3 + H 2 O ⇄ NH 4 + + OH - L'ammoniaca è una base debole e lo ione ammonio che è il suo acido coniugato è forte mentre l'acqua che è un acido debole ha, come base coniugata OH - che è forte.