pOH = - log 0.0476 = 2.3. pH = 14-2.3 = 11.7. La curva di titolazione è costruita mettendo in ascisse il volume di NaOH aggiunto e in ordinate il pH. Questa curva differisce a seconda della concentrazione iniziale dell'acido e della sua costante di dissociazione ed ha un andamento del tipo mostrato in figura.. Curva di titolazione acido debole base forte-chimicamo. Chimica Today. 20 Maggio 2020. Punti chiave. Costruzione della curva di titolazione. Negli esercizi di chimica analitica è spesso richiesto il valore del pH nel corso di una titolazione al fine di poter costruire la relativa curva.

Equilíbrio ÁcidoBase 15 Curva de titulação empregando o Excel 4 Base fraca com ácido forte

Curva di titolazione acido debole base forte Nel

Curve di titolazione acido forte/base forte e acido debole/base forte a confronto YouTube

Curva di titolazione acido debole base forte Nel
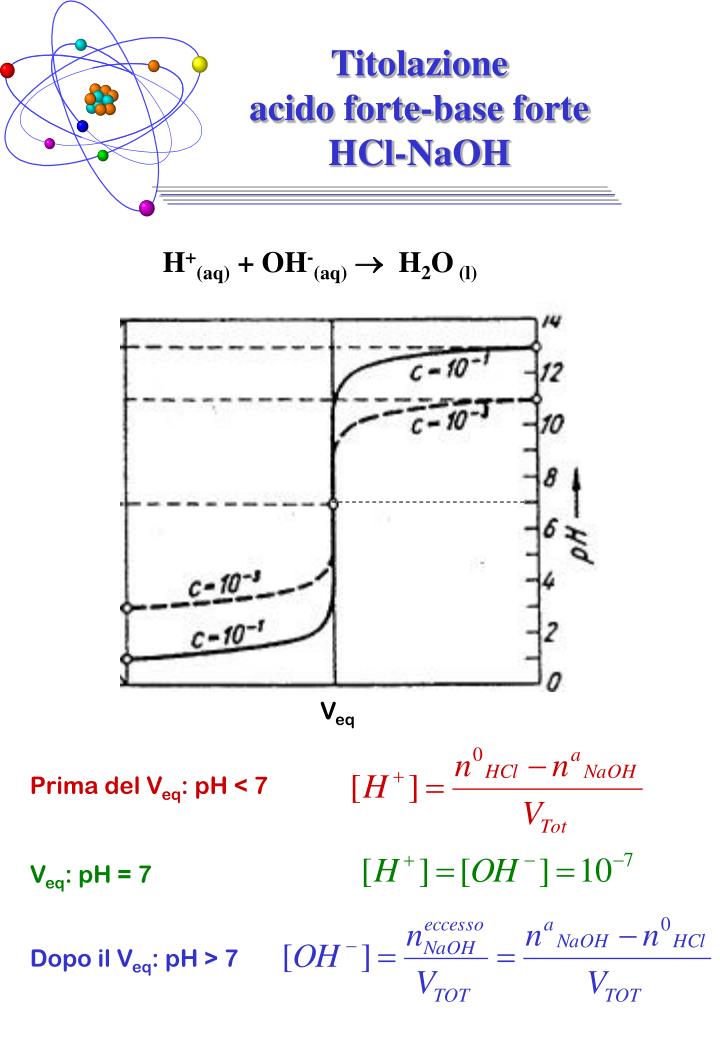
PPT Titolazione acido fortebase forte HClNaOH PowerPoint Presentation ID3571283

PPT Introduzione ai metodi basati sulla titolazione analisi volumetrica PowerPoint
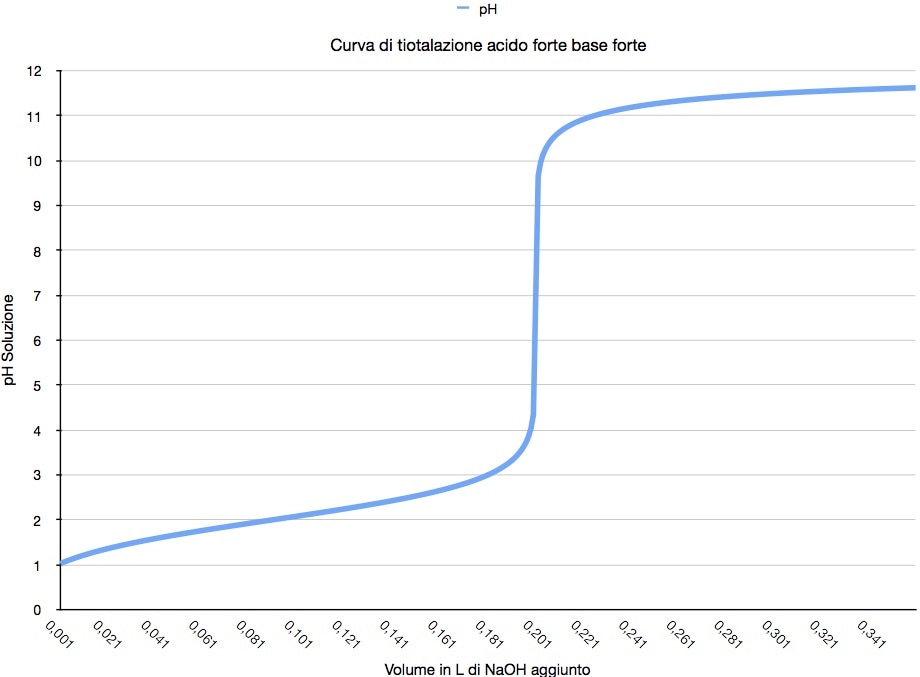
Grafico Titolazione Acido Debole Base Forte oqudina

Curva di titolazione acido debole base forte Nel
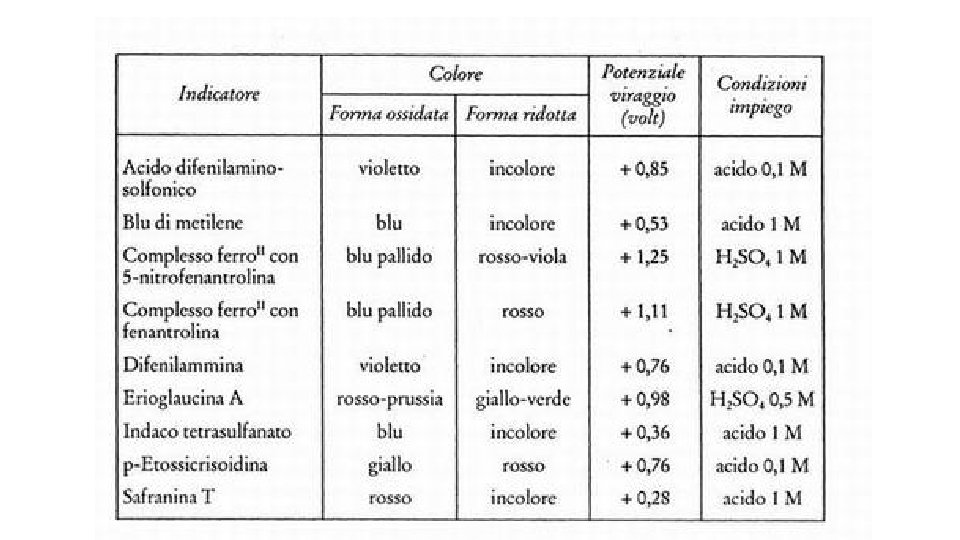
Curva di titolazione acido debole base forte Nel

Curva Titolazione Acido Forte Base Forte erasquyes

Curva Titolazione Acido Debole Base Debole roancaster
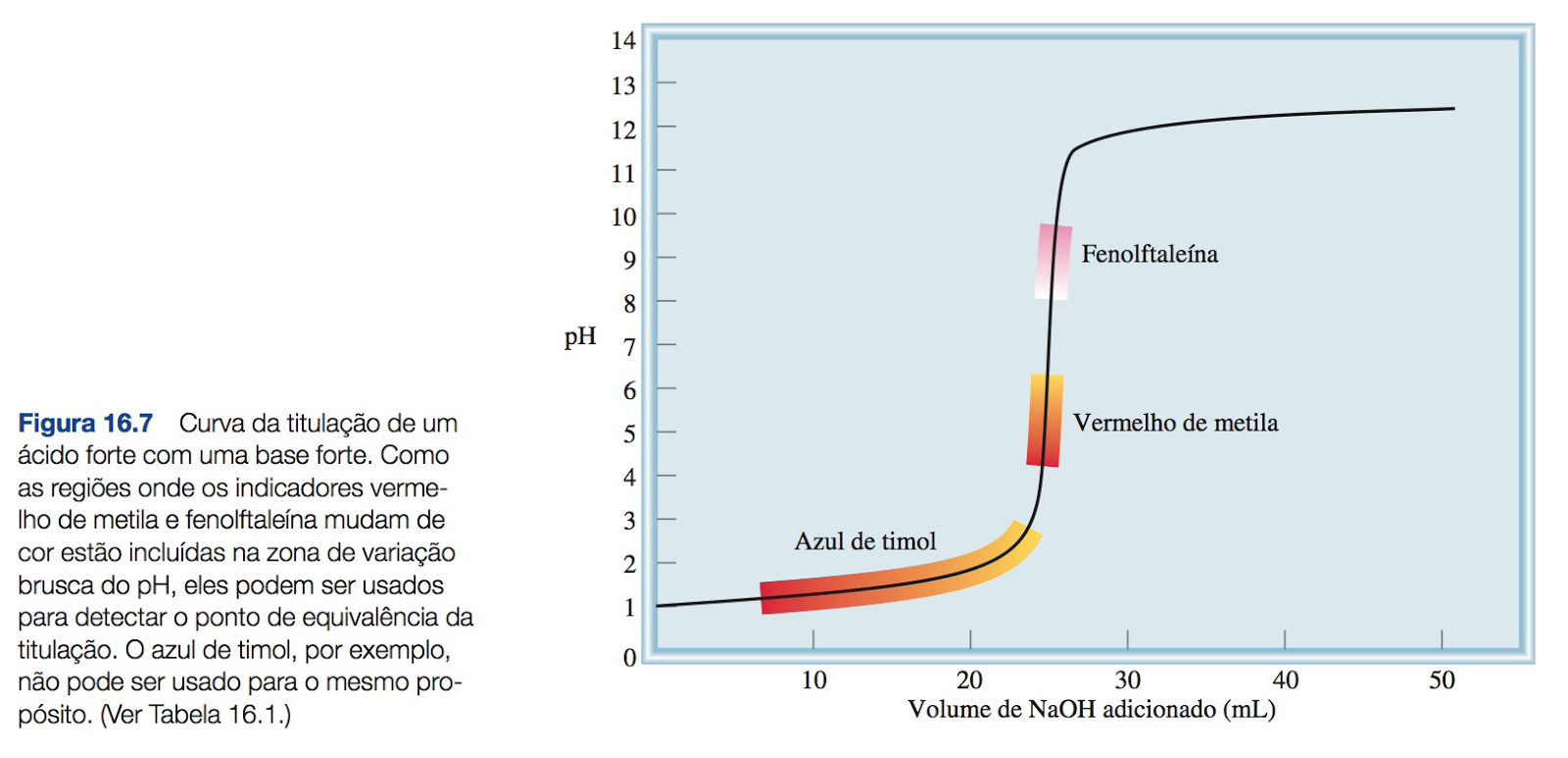
Curva da titulação de um ácido forte com uma base forte
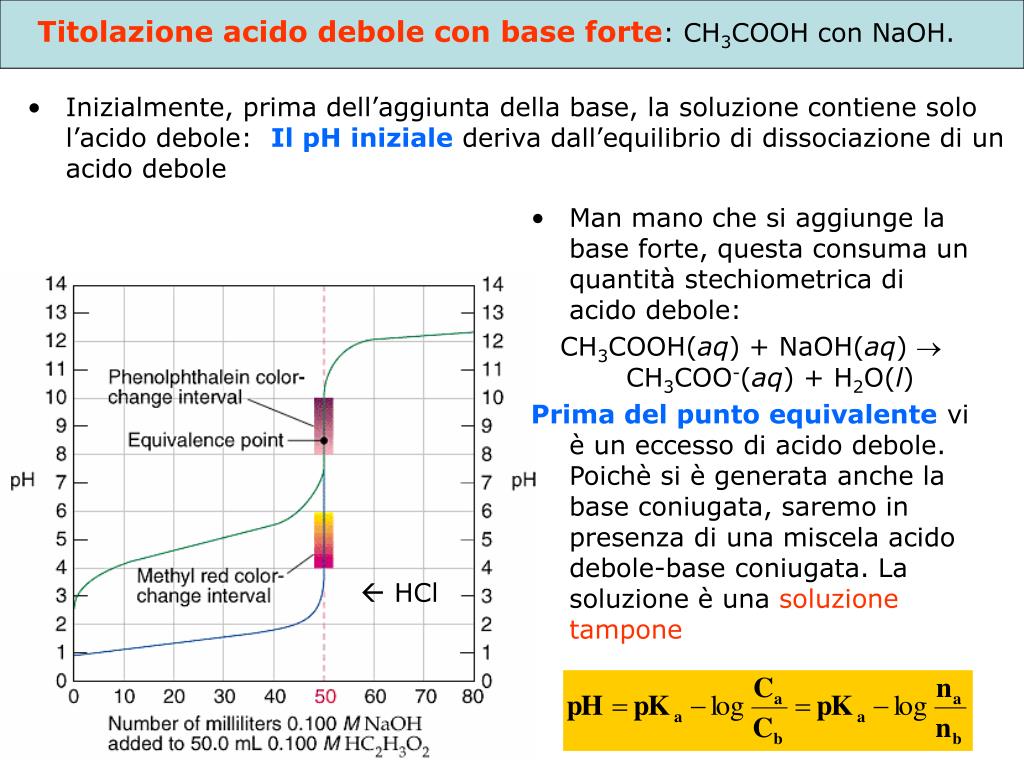
PPT Introduzione ai metodi basati sulla titolazione analisi volumetrica PowerPoint

PPT Titolazioni PowerPoint Presentation, free download ID777592
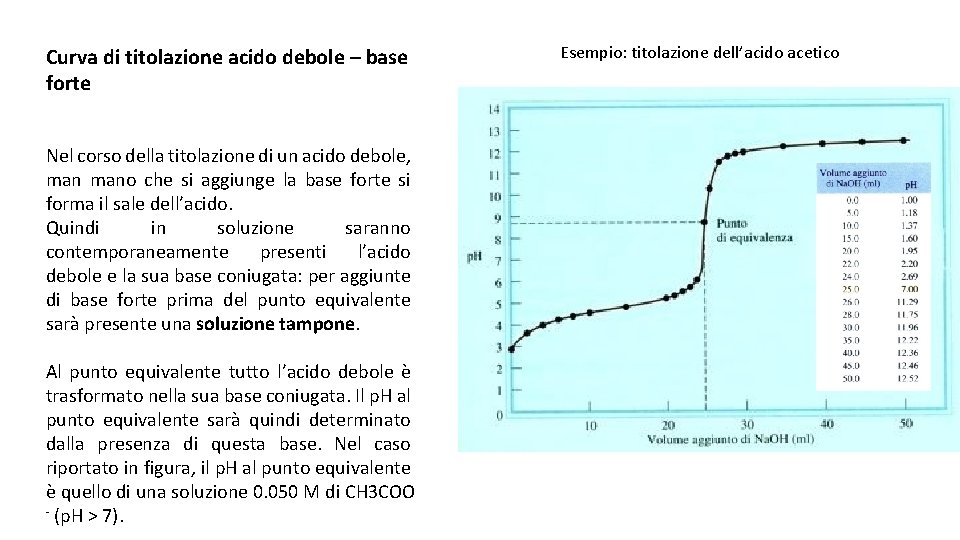
Curva di titolazione acido debole base forte Nel

PPT curva di titolazione base deboleacido forte PowerPoint Presentation ID4898016

Curva di titolazione acido debole base forte Nel

PPT curva di titolazione acido debolebase forte PowerPoint Presentation ID4911919

PPT curva di titolazione acido debolebase forte PowerPoint Presentation ID4911919

Laboratorio di chimica analitica curve di titolazione acidobase YouTube
CURVA DI TITOLAZIONE DI UN ACIDO FORTE CON UNA BASE FORTE. HCl= titolato (beuta) NaOH= titolante (buretta) 100 mL di HCl 0.100 M, calcoliamo il pH al punto iniziale e dopo aver aggiunto 50, 100, 150 mL di NaOH 0.100 M.. Poiché. [H3O+] = x [A-] = x [HA] = Ca - x. posso scrivere: 1,2×10-2 = x 2/ (0,096 - x) In questo caso la x non può essere trascurata, quindi devo risolvere l'equazione di 2° grado: [H3O+] = [-Ka + √ (Ka2 + 4KaCa)]/ 2 = 2,85×10-2 M. Quindi: [H3O+] = 2,85×10-2 e pH = -log 2,85×10-2 = 1,55. 2. pH a 2,0 ml di NaOH: